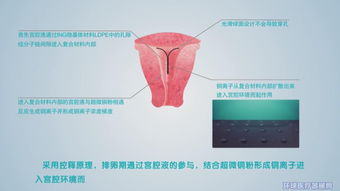
在醫療器械行業,產品安全有效是保障公眾健康的第一道防線。對于風險程度較低、實行常規管理即可保證其安全有效的第一類醫療器械,其上市前同樣需要經過嚴格的檢測程序,以確保其質量和性能符合國家標準。在四川,所有第一類醫療器械產品在正式上市前,都必須先到指定的檢測機構“過檢測關”,這是產品合法進入市場的必經之路。
第一類醫療器械通常是指那些通過常規管理足以保證其安全性和有效性的器械,如外科用手術器械、聽診器、醫用X光膠片等。盡管風險較低,但并不意味著可以放松監管。根據《醫療器械監督管理條例》規定,第一類醫療器械實行產品備案管理。備案前,產品必須符合相關的國家標準或行業標準,并經過檢驗合格。
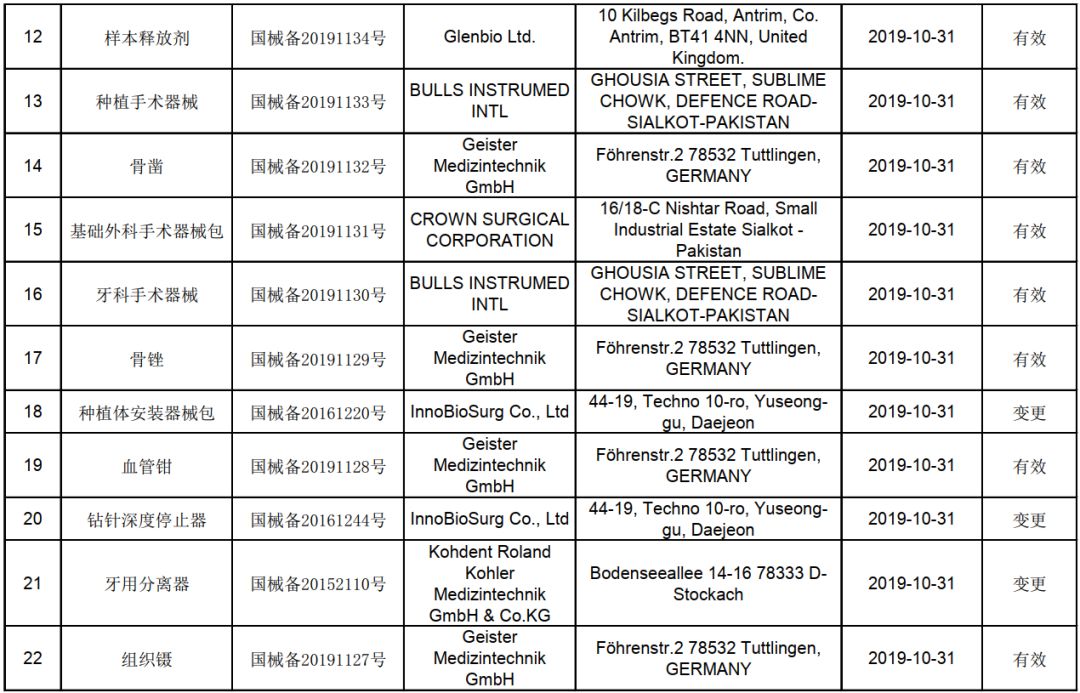
在四川,承擔這一重要檢測任務的機構是經國家藥品監督管理部門認可的醫療器械檢測機構。這些機構擁有先進的檢測設備和技術力量,能夠對第一類醫療器械的物理性能、化學性能、生物安全性等關鍵指標進行全面、科學的檢測。生產企業需要將產品樣品送至這些機構,按照相關標準進行檢測,并獲得合格的檢驗報告。
檢測過程通常包括以下幾個關鍵環節:對產品的外觀、結構、尺寸等進行初步檢查;進行性能測試,確保其功能達到設計要求;再次,進行生物相容性評估,確保與人體接觸時不會產生不良反應;對產品的標簽、說明書等進行審核,確保信息準確、完整。只有所有檢測項目均合格后,檢測機構才會出具合格的檢驗報告。
獲得合格的檢測報告后,生產企業才能向四川省藥品監督管理部門提交產品備案申請。備案過程中,監管部門會審核產品的檢測報告、生產企業的資質證明、產品技術要求等文件。一旦備案成功,產品即獲得上市資格,可以在市場上合法銷售和使用。
這一嚴格的檢測程序不僅是對消費者健康的負責,也是對企業自身發展的保障。通過檢測,企業可以及時發現產品存在的潛在問題,進行改進和優化,從而提升產品質量和市場競爭力。這也是監管部門履行監管職責、維護市場秩序的重要手段。
四川對第一類醫療器械實行上市前檢測制度,體現了對醫療器械安全性的高度重視。這道“檢測關”是確保醫療器械安全有效的關鍵環節,為公眾健康筑起了一道堅實的防線。生產企業應積極配合檢測工作,確保產品符合標準,共同促進醫療器械行業的健康發展。