第一類醫療器械是指風險程度較低,實行常規管理足以保證其安全、有效的醫療器械。正確確定醫療器械的分類,尤其是第一類,是企業合規生產、經營和注冊備案的前提。以下是確定第一類醫療器械分類的關鍵步驟與考量因素:
1. 依據法規目錄進行初步判斷
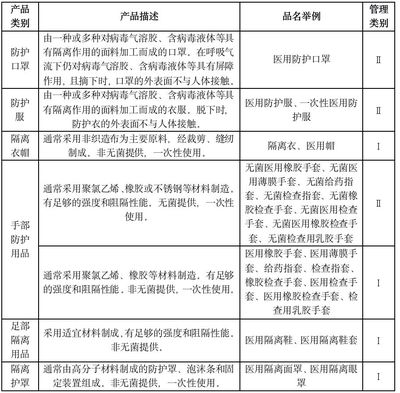
國家藥品監督管理局會發布《醫療器械分類目錄》及相關的分類界定指導文件。這是最直接、最權威的判斷依據。企業應首先查閱最新版目錄,核對產品描述、預期用途等是否與目錄中列明的第一類產品吻合。例如,大部分的外科手術器械(非無菌提供)、基礎敷料、醫用檢查手套等通常屬于第一類。
2. 分析產品的風險程度
第一類醫療器械的核心特征是“風險程度低”。判斷時需綜合評估:
- 使用形式:是否為非接觸人體或僅接觸體表?例如,聽診器、醫用冷敷貼。
- 作用機制:其作用是否主要是物理支撐、防護或不涉及藥理學、免疫學代謝?例如,輪椅、醫用繃帶。
- 作用時間:是否為暫時使用(短于30天)?例如,一次性使用口腔器械盒。
- 侵入性:是否非侵入或僅涉及體表通道(如口腔、鼻腔)且不損傷組織?
3. 明確預期用途
產品的分類與其聲明的預期用途緊密相關。同樣的物理結構,如果用途聲明不同,分類可能提升。例如,一個普通眼鏡片屬于第一類,但如果有“矯正視力”的醫療器械用途聲明,則可能屬于第二類。因此,產品說明書、標簽上的預期用途描述必須清晰、準確,且與分類判定依據保持一致。
4. 參考同類產品與已有分類界定
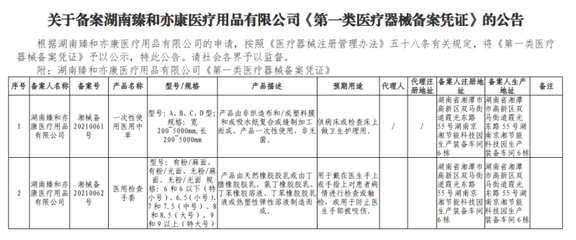
可以查詢國家藥監局醫療器械標準管理中心發布的“醫療器械分類界定結果匯總”。如果已有結構、原理、用途相似的產品被明確界定為第一類,可作為重要參考。但需注意產品之間可能存在細微但關鍵的差異。
5. 進行分類界定申請(如有疑慮)
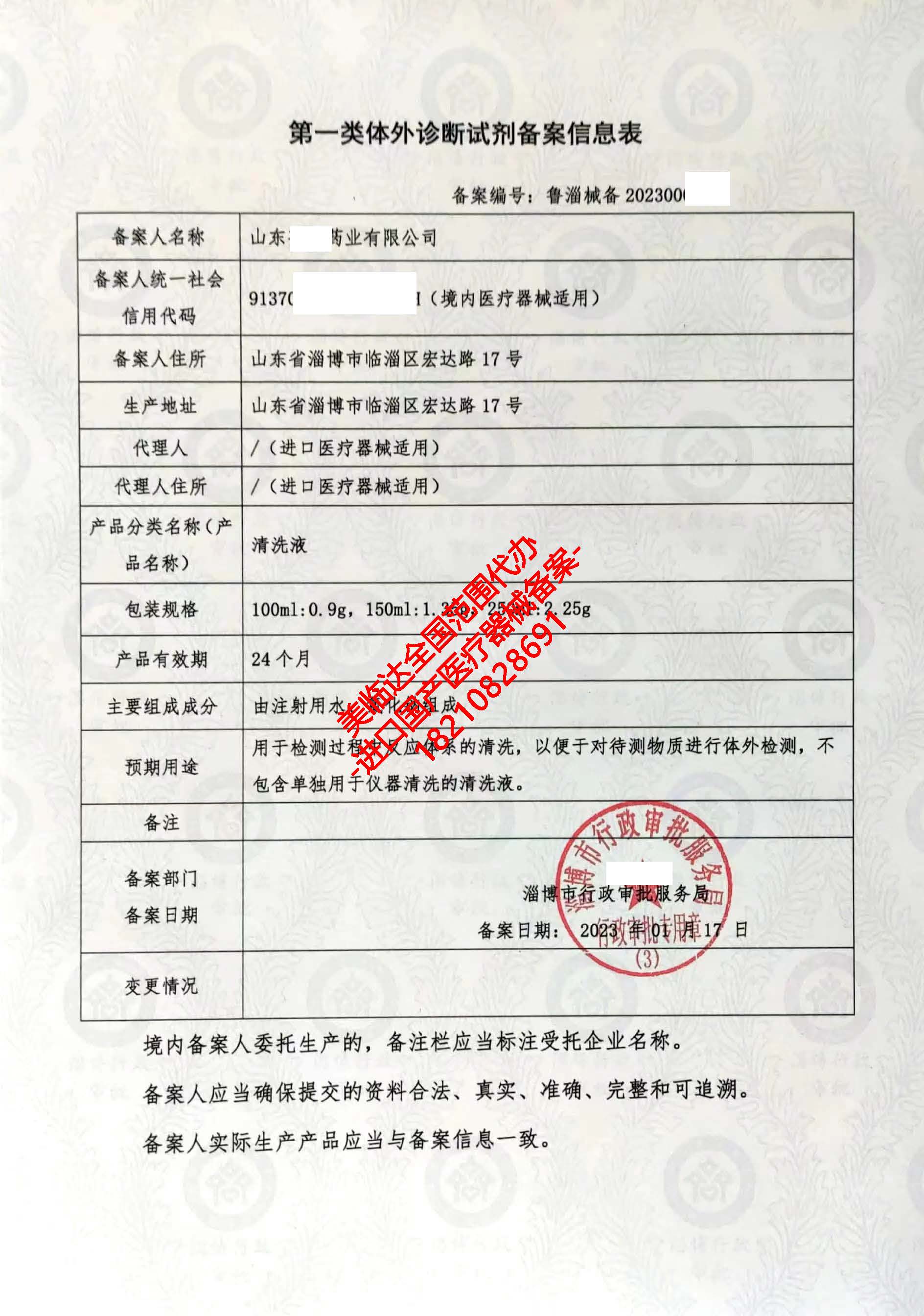
如果通過以上步驟仍無法明確判斷,或產品新穎、目錄中未涵蓋,企業應向國家藥監局醫療器械標準管理中心提交分類界定申請。提供詳細的產品技術說明、預期用途、工作原理等資料,由官方給出權威界定。這是解決分類爭議的根本途徑。
6. 關注動態與咨詢專業人士
醫療器械法規和分類目錄會動態更新。企業需保持關注。對于復雜情況,咨詢專業的醫療器械法規事務人員或機構是避免分類錯誤的有效方法。
****:確定第一類醫療器械分類是一個系統性的工作,需要企業嚴格對標法規目錄,基于產品風險進行審慎分析,并確保產品描述與實際用途一致。正確的分類是產品合法上市的第一步,務必給予足夠重視。