第一類醫療器械是指風險程度低,實行常規管理可以保證其安全、有效的醫療器械。根據《醫療器械監督管理條例》的相關規定,對第一類醫療器械的監管實行備案管理。而“第一類醫療器械備案信息表”則是這一管理流程中的核心文件。
一、備案信息表的核心作用
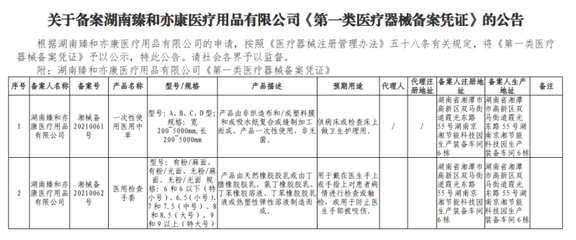
該信息表是境內第一類醫療器械備案人(通常為醫療器械生產企業)或進口第一類醫療器械的境外備案人,在向相應藥品監督管理部門提交備案申請時所必須填寫的正式表格。其主要作用是記錄醫療器械的基本信息、分類信息、備案人信息、產品技術要求等,是監管部門對產品進行登記和后續監管的依據。
二、備案信息表的主要內容
一份完整的第一類醫療器械備案信息表通常包含以下關鍵信息:
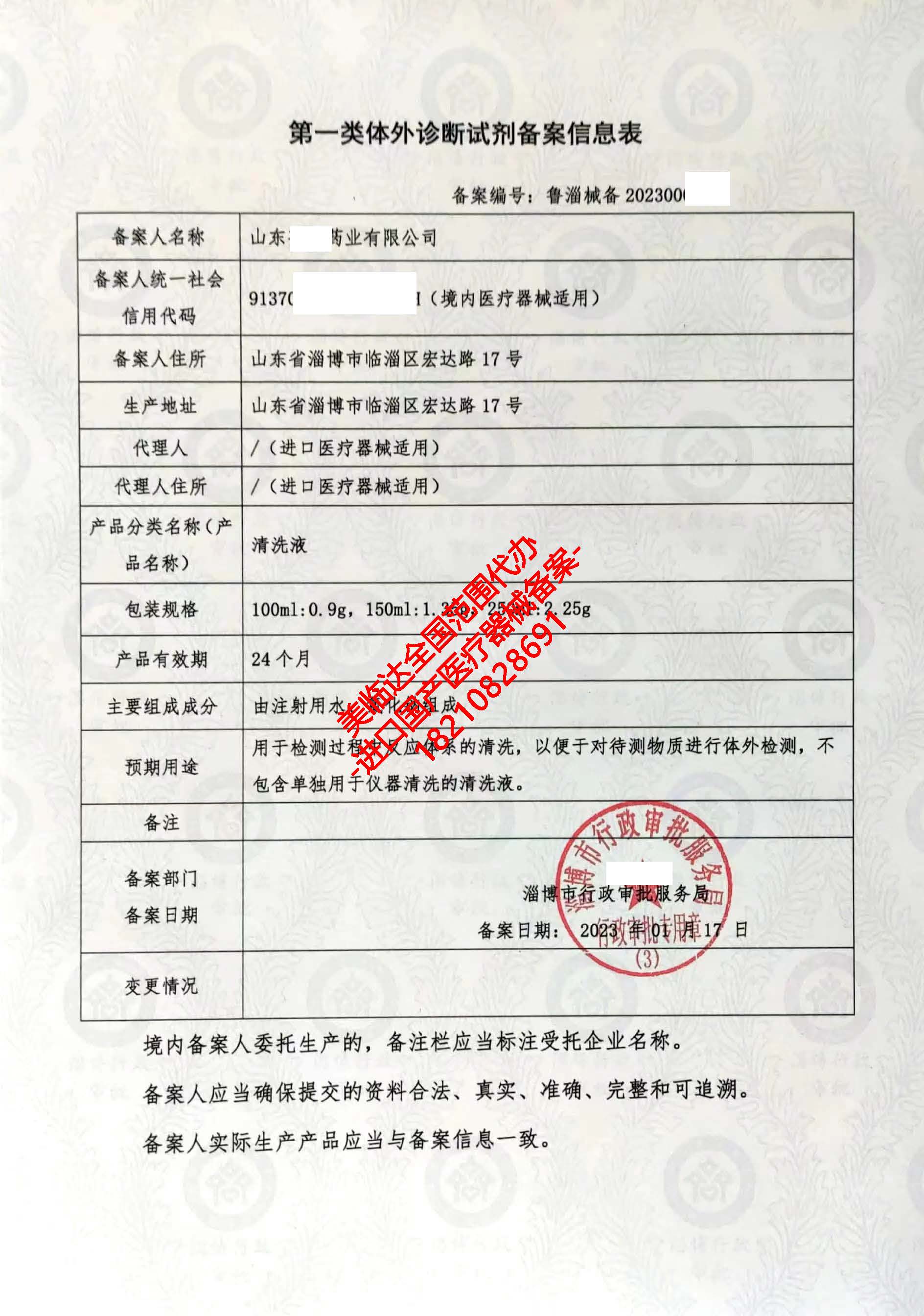
- 備案人信息:包括備案人名稱、住所、聯系方式、統一社會信用代碼等。對于進口產品,還需提供境外備案人及代理人的相關信息。
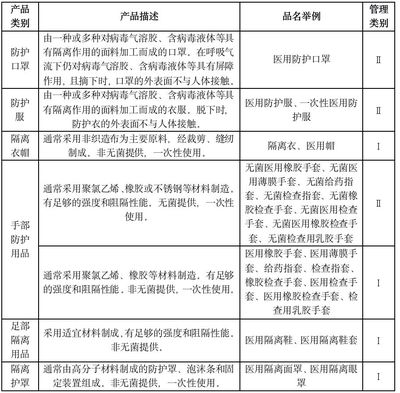
- 產品基本信息:包括產品名稱、型號/規格、產品描述、預期用途、分類編碼(根據醫療器械分類目錄)等。
- 產品技術要求:簡述產品應當符合的強制性國家標準、行業標準,或備案人自行制定的產品技術要求。
- 產品檢驗報告:聲明產品檢驗合格,并承諾提交的備案資料真實、完整、可追溯。
- 臨床評價資料:聲明產品符合第一類醫療器械免于進行臨床評價的相關規定。
- 生產制造信息:境內生產需提供生產企業信息;委托生產需提供受托企業信息及委托合同;進口產品需提供境外生產企業信息。
- 其他聲明與簽章:備案人承諾對備案資料的真實性負責,并由法定代表人或授權人簽字,加蓋公章。
三、備案流程簡介
備案人需通過國家藥品監督管理局指定的在線政務服務平臺,在線填寫并提交《第一類醫療器械備案信息表》及相關電子資料。資料符合要求的,藥品監督管理部門將即時完成備案,并公布備案號及備案信息。備案人可自行下載打印備案憑證。
四、重要注意事項
- 真實性與合規性:備案人對備案資料的真實性、準確性、完整性、合法性和可追溯性負全部責任。備案信息發生變化時,應及時提交變更備案。
- 非注冊審批:備案不等同于注冊審批,不代表監管部門對產品安全有效性的“批準”,而是基于備案人的自我聲明和承諾進行的存檔備查。
- 動態監管:完成備案后,產品即可上市銷售。但監管部門會通過監督檢查、抽樣檢驗等方式進行上市后監管,確保產品持續符合要求。
總而言之,《第一類醫療器械備案信息表》是第一類醫療器械上市前合規準入的關鍵一步。企業務必確保信息填報準確、完整,并理解備案管理的責任與義務,確保產品在整個生命周期內安全有效。